DISOLUCIONES
Una disolución es una mezcla homogénea de dos o más
sustancias de composición variable.
En una disolución hay al menos dos componentes:
1. Soluto: La
sustancia que se disuelve.
2. Disolvente: Medio en el que se disuelve
el soluto.
Cuando la cantidad de soluto en el disolvente es pequeña
hablamos de una disolución diluida, pero cuando la cantidad de soluto es alta,
hablamos de disoluciones concentradas. Además cada disolvente tiene una
capacidad limitada de admitir soluto, por lo que si se supera esa capacidad, la
disolución se llama saturada, y en este tipo de disoluciones ya no se puede
añadir mayor cantidad de soluto.
CONCENTRACIÓN:
La concentración es el método para indicar la composición de
una disolución y indica la cantidad de soluto que hay disuelta en el
disolvente.
Hay diversas formas de expresar la concentración:
1. Una forma
muy utilizada es gramos / litros:
2. Tanto por ciento en masa:
EJEMPLO:
Se disuelven 7 gramos de cloruro sódico en 43 g de agua. Calcula
el tanto por ciento en masa:
Como tenemos el soluto
en gramos (7g) y el disolvente en gramos (43g) sólo tenemos que sumarlos para
obtener los gramos de la disolución: 7g + 43g = 50 g disolución.
Ahora podemos aplicar
la fórmula:
3. Tanto por ciento en volumen:
4.
Molaridad:
EJEMPLO:
Disolvemos 4,9 g de ácido sulfúrico en agua hasta conseguir una
disolución de 200 cm3. ¿Cuál es la molaridad de esta disolución?
En primer lugar
calculamos los moles de H2SO4 y para ello debemos conocer
la masa del compuesto (H = 1u, O = 16u y S =32u). El ácido sulfúrico pesa:
(1x2) + 32 + (16x4) = 98u
Ahora debemos convertir
los 200 cm3 de disolución en litros:
Ahora si podemos
calcular la molaridad:
5. Molalidad:
EJEMPLO:
Se disuelven 7 gramos de cloruro sódico en 43 gramos de agua.
Calcula la molalidad:
En primer lugar debemos
encontrar los moles de soluto y para ello debemos saber la masa atómica del
NaCl (Na = 22,98u y Cl = 35,45u). 22,98 + 35,45 = 58,43u. Ahora encontramos los
moles de soluto:
Ahora debemos saber los
kg de disolvente 43 g : 1000 = 0,043 Kg.
Una vez hecho esto,
podemos aplicar la fórmula:
6. Fracción molar:
EJEMPLOS:
1. Determina el porcentaje
en masa, la molaridad, la molalidad y la fracción molar de una disolución que
tiene 2g de Ca(OH)2 i 200 cm3 de agua. Esta disolución
tiene una densidad de 1,05 g/cm3.
En primer lugar debemos
interpretar bien los términos para poder hallar cada uno de los componentes de
la disolución.
El enunciado nos dice
que se disuelven 2 g de Ca(OH)2 luego este es el soluto, i tenemos
200 cm3 de agua que serán el disolvente.
Antes de nada, debemos
calcular los gramos totales de la disolución, y para ello debemos saber
los gramos de disolvente que hay en la disolución. Como el disolvente es el
agua, sabemos que:
Entonces, como tenemos
200 cm3 de agua, mirando la equivalencia de arriba sabemos que
también hay 200 g H2O. Por tanto el peso total de la disolución
será:
Una vez sabemos los
gramos de la disolución, otra cosa que debemos saber es el volumen total de
la disolución. Esto lo sabemos a partir de la densidad. La densidad sigue
la siguiente fórmula:
Sabemos que nuestra
disolución tiene una densidad de 1,05 g/cm3 y también sabemos la
masa de la disolución porque la acabamos de encontrar, entonces:
Ahora tenemos todos los
datos que necesitamos para iniciar los cálculos de la concentración:
Gramos soluto
|
Gramos disolvente
|
Gramos disolución
|
Volumen disolución
|
2 g
|
200 g
|
202 g
|
192,3 cm3
|
En primer lugar
encontramos la molaridad:
Sabemos que la
molaridad es:
En este caso, para
encontrar la molaridad, en primer lugar debemos hallar el número de moles de
soluto a través de factores de conversión, sabiendo que el peso del Calcio es
40u, el del Oxígeno 16u y el del Hidrógeno 1u.
Ahora ya sabemos los
moles de soluto, pero necesitamos tener el volumen de la disolución en litros,
así que tendremos que convertir el volumen, que tenemos en centímetros cúbicos
a litros:
Una vez hemos hallado
lo que necesitamos podemos aplicar la fórmula de la molaridad:
Ahora vamos
a hallar el porcentaje en masa, para ello debemos aplicar la siguiente
fórmula:
Como tenemos hallados
tanto los gramos de soluto como los de la disolución, podemos aplicar la
fórmula:
En tercer lugar vamos a
hallar la molalidad, y para ello tenemos que aplicar la siguiente fórmula:
Los moles
de soluto (0,02 moles) los hemos hallado antes, y sabemos los gramos de
disolvente (200g), así que debemos convertir los gramos del disolvente en kg de
disolvente:
Ahora si podemos
aplicar la fórmula de la molalidad:
Finalmente vamos a
calcular la fracción molar:
Para
calcular la fracción molar debemos hallar los moles totales, y para ello en
primer lugar debemos encontrar los moles de disolvente, ya que los de soluto ya
los sabemos (0,02moles):
Los moles totales serán
entones: 11,11 moles H2O + 0,02 moles Ca(OH)2 = 11,13
moles disolución
Ahora podemos calcular
la fracción molar:
2. Calcula el volumen que
tendrá una disolución 0,2M de ácido sulfúrico que tiene 2,5g de soluto.
Como sabemos la
molaridad, podremos encontrar el volumen de la disolución a través de esta
fórmula:
Para ello debemos
encontrar primero el número de moles del soluto sabiendo que tenemos 2,5 gramos
de soluto, es decir, de ácido sulfúrico. El ácido sulfúrico pesa: (1x2) + 32 +
(16x4) = 98u
Ahora podemos encontrar
los litros (es decir, el volumen) de la disolución:






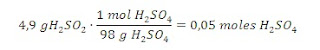





















No hay comentarios:
Publicar un comentario