LEYES DE LOS GASES:
LEY
|
TEORIA
|
ECUACIÓN
|
|
LEY
DE BOYLE – MARIOTTE
|
A temperatura constante (isotérmica) si la presión ejercida por un
gas aumenta, el volumen disminuye de forma inversamente proporcional.
|
K = Constante de proporcionalidad que depende de la masa i la
temperatura del gas.
|
|
Ejemplo: Una masa de un
gas ocupa un volumen de 2 litros a 20ºC i a una presión de 101300Pa. Qué
volumen ocupará este gas a la misma temperatura i a una presión de 202600Pa?
Utilizamos la ley de Boyle –
Mariotte:
|
|||
LEY
DE CHARLES
|
A presión constante (isobárica) el volumen de un gas aumenta
proporcionalmente con la temperatura.
|
(p y n son constantes)
|
|
Ejemplo: Una masa de gas ocupa
un volumen de 1,4 L a 25ºC. ¿Qué volumen tendrá a una temperatura de – 10ºC?
Primero tendremos que convertir
los grados a Kelvin:
T1
= 25 + 273 = 298º K
T2
= - 10 + 273 = 263ª K
Ahora calculamos con la ley de
Charles el segundo volumen:
|
|||
LEY
DE GAY – LUSSAC
|
A volumen constante la presión de un gas aumenta proporcionalmente
con la temperatura.
|
(V y n son
constantes)
|
|
Ejemplo: ¿Qué presión
tendrá un deposito que contiene un gas a 40ºC si a 5ºC tiene una presión de
1,5·105Pa?
Primero de todo, debemos poner
la temperatura en grados Kelvin (esto deberemos hacerlo siempre):
T1
= 5 + 273 = 278º K
T2
= 40 + 273 = 313º K
Ahora aplicamos la ley de Gay –
Lussac:
|
|||
LEY
DE AVOGADRO
|
El mismo volumen de gases diferentes, en las mismas condiciones de
presión y temperatura, contienen el mismo nombre de partículas y por tanto el
mismo número de moles.
|
(p y T son constantes)
|
|
LEY
DE LOS GASES IDEALES
|
Esta ecuación resulta de la combinación de las leyes de Avogadro,
Boyle – Mariotte y Charles.
También se cumple en los gases reales a presiones bajas.
|
(R es la constante de
los gases)
|
|
Ejemplo: ¿Qué presión
ejercen 10g de hidrógeno si están a 300ºC y ocupan un volumen de 80L?
(R = 8,314 J/(mol·K))
Es necesario obtener los moles
de hidrógeno a través de factores de conversión:
También debemos convertir las
otras magnitudes a las que indica el sistema internacional:
Ahora podemos aplicar
la ley de los gases ideales:
|
|||
LEY
DE DALTON
|
En una mescla de gases, la presión total es la suma de las presiones
parciales de cada gas de la mescla.
|
||

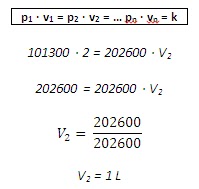









No hay comentarios:
Publicar un comentario