LA MATERIA
ESTRUCTURA DE LA MATERIA.
La materia está formada por átomos.
Los átomos tienen dos partes: la corteza y el núcleo.
El núcleo está formado por dos tipos de partículas: los protones y los neutrones.
En la corteza encontramos los electrones.
Cada protón y neutrón tienen una masa aproximadamente igual, qué es 1836 veces superior a la de un electrón de la corteza.
Además, el número de protones tiene que ser igual al de electrones, para que el átomo sea neutro o estable.
1. NÚMERO ATÓMICO:
El nombre atómico es el número de protones que tiene el núcleo de un átomo. Cada elemento tiene uno, y por tanto este número caracteriza cada elemento. Lo simbolizamos con la letra Z.
Número atómico (Z) = Número de protones
2. NÚMERO MÁSICO:
Es la suma del número de protones y neutrones. Lo simbolizamos con la letra A.
Número másico (A) = número de protones + número de electrones
3. ISÓTOPOS:
Los isótopos son los diferentes átomos de un mismo elemento, que pueden tener el mismo número atómico pero diferente número másico.
4. MASA ATÓMICA:
La masa atómica es la media aritmética d las masas atómicas de los isótopos de un elemento.
5. MOL:
Un mol es la cantidad de sustancia de un sistema. Un mol es siempre igual al número de Avogadro (NA = 6,022 · 1023).
ESQUEMA DE LAS PRINCIPALES TRANSFORMACIONES DE LA MATERIA:
Ejemplos:
1. A cuantos moles equivalen 20 gramos de oxígeno?
(Peso oxígeno = 16g)
Solucionamos con factores de conversión teniendo en cuenta el esquema anterior:
2. Cuantos gramos tienen dos moléculas de NaCl?
(Peso atómico Cl = 35,45g // Peso atómico Na = 22,98)
Solucionamos con factores de conversión teniendo en cuenta el esquema anterior:
Tenemos que calcular cuánto pesa un mol: Como solo hay un átomo de cada, solo tenemos que sumar los dos pesos: 35,45 + 22,98 = 58,43g
ESTADOS DE LA MATERIA
ESTADOS DE LA MATERIA
| |||
SÓLIDO
|
LÍQUIDO
|
GASEOSO
| |
FUERZAS DE ATRACCIÓN
|
Elevadas.
Las partículas están muy cercanas entre sí.
Solo tienen movimiento de vibración.
|
Más débiles que en los sólidos.
Las partículas están más separadas pero con distancias intermoleculares fijas.
Tienen movimiento de vibración y rotación.
|
Prácticamente nulas.
Las partículas están muy separadas y con movimiento continuo y aleatorio.
|
VOLUMEN
|
Fijo.
A causa de las fuerzas de atracción entre las partículas.
|
Fijo.
La distancia entre las partículas es más o menos constante.
|
Ocupan todo el volumen del recipiente que las contiene. No hay fuerza de atracción entre las partículas.
|
FORMA
|
Fija. Las partículas sólo vibran.
Según la disposición de las partículas, pueden ser:
- Cristalina: Ordenación predeterminada.
- Amorfa: Sin ordenación predeterminada.
|
Sin forma propia. Se adapta al recipiente que las contiene. Las partículas en el movimiento de translación resbalan unas entre las otras. Presentan una presión hidrostática.
|
No tienen forma propia. Las partículas están en movimiento constante.
|
COMPRESIVIDAD
|
Incompresibles. Las partículas están muy juntas.
|
Casi incompresibles, las distancias entre partículas son fijas.
|
Compresibles. Las partículas están muy separadas y puede variar la distancia entre ellas.
|
DENSIDAD
|
Más alta que en otros estados. Las partículas están muy juntas, la materia es compacta.
|
Más baja que la de los sólidos. Las partículas están más separadas que en los sólidos.
|
Baja. Las partículas están muy separadas, son poco compactas.
|
LEYES DE LOS GASES:
LEY
|
TEORIA
|
ECUACIÓN
| |
LEY DE BOYLE – MARIOTTE
|
A temperatura constante (isotérmica) si la presión ejercida por un gas aumenta, el volumen disminuye de forma inversamente proporcional.
|
K = Constante de proporcionalidad que depende de la masa i la temperatura del gas.
| |
Ejemplo: Una masa de un gas ocupa un volumen de 2 litros a 20ºC i a una presión de 101300Pa. Qué volumen ocupará este gas a la misma temperatura i a una presión de 202600Pa?
Utilizamos la ley de Boyle – Mariotte:
| |||
LEY DE CHARLES
|
A presión constante (isobárica) el volumen de un gas aumenta proporcionalmente con la temperatura.
|
(p y n son constantes)
| |
Ejemplo: Una masa de gas ocupa un volumen de 1,4 L a 25ºC. ¿Qué volumen tendrá a una temperatura de – 10ºC?
Primero tendremos que convertir los grados a Kelvin:
T1 = 25 + 273 = 298º K
T2 = - 10 + 273 = 263ª K
Ahora calculamos con la ley de Charles el segundo volumen:
| |||
LEY DE GAY – LUSSAC
|
A volumen constante la presión de un gas aumenta proporcionalmente con la temperatura.
|
(V y n son constantes)
| |
Ejemplo: ¿Qué presión tendrá un deposito que contiene un gas a 40ºC si a 5ºC tiene una presión de 1,5·105Pa?
Primero de todo, debemos poner la temperatura en grados Kelvin (esto deberemos hacerlo siempre):
T1 = 5 + 273 = 278º K
T2 = 40 + 273 = 313º K
Ahora aplicamos la ley de Gay – Lussac:
| |||
LEY DE AVOGADRO
|
El mismo volumen de gases diferentes, en las mismas condiciones de presión y temperatura, contienen el mismo nombre de partículas y por tanto el mismo número de moles.
|
(p y T son constantes)
| |
LEY DE LOS GASES IDEALES
|
Esta ecuación resulta de la combinación de las leyes de Avogadro, Boyle – Mariotte y Charles.
También se cumple en los gases reales a presiones bajas.
|
(R es la constante de los gases)
| |
Ejemplo: ¿Qué presión ejercen 10g de hidrógeno si están a 300ºC y ocupan un volumen de 80L?
(R = 8,314 J/(mol·K))
Es necesario obtener los moles de hidrógeno a través de factores de conversión:
También debemos convertir las otras magnitudes a las que indica el sistema internacional:
Ahora podemos aplicar la ley de los gases ideales:
| |||
LEY DE DALTON
|
En una mescla de gases, la presión total es la suma de las presiones parciales de cada gas de la mescla.
| ||
CAMBIOS DE ESTADO DE LA MATERIA:
En el siguiente esquema se muestran los diferentes cambios de estado posibles de la materia:
1. DE SÓLIDO A LÍQUIDO:
- Fusión: Calentar un sólido para que pase a líquido.
- Solidificación: Enfriar un líquido para que pase a sólido.
La temperatura a la que suceden estos fenómenos es siempre la misma y se llama Temperatura de fusión (Tf). Esta temperatura varía con la presión. El punto de fusión o solidificación es la temperatura a la que un sólido pasa a líquido o al contrario a una presión de 1 atmósfera (1,013 · 105 Pa).
2. DE LÍQUIDO A GAS:
- Vaporización: Proceso por el que la materia pasa de líquido a gas.
Dependiendo de en qué parte de la materia se produzca este cambio, la vaporización puede tomar dos nombres:
a) Vaporización: Si se da en la superficie del líquido.
b) Ebullición: Si se da en todo el líquido.
- Condensación: Paso de estado gaseoso a líquido.
La temperatura de ebullición puede variar mucho en función de la presión. Por eso, se determina el punto de ebullición, que es la temperatura de ebullición a 1 atmósfera de presión.
3. SÓLIDO A GAS:
El paso de sólido a gas sin pasar por el intermedio (líquido) se llama sublimación. El proceso inverso se llama también sublimación o cristalización.
Este fenómeno tiene lugar en todos los sólidos pero se observa mejor en los que presentan una presión de vapor muy alta a temperatura ambiente, de manera que subliman rápidamente.








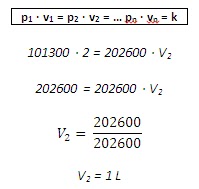












Este comentario ha sido eliminado por el autor.
ResponderEliminarEste comentario ha sido eliminado por el autor.
EliminarEste comentario ha sido eliminado por el autor.
EliminarEste comentario ha sido eliminado por el autor.
EliminarEste comentario ha sido eliminado por el autor.
EliminarEste comentario ha sido eliminado por el autor.
EliminarEste comentario ha sido eliminado por el autor.
EliminarEste comentario ha sido eliminado por el autor.
ResponderEliminarEste comentario ha sido eliminado por el autor.
ResponderEliminar